このほど、東京大学先端科学研究センター(東京都目黒区駒場、中野義昭所長)システム生物医学分野の小林美佳研究員、神吉康晴特任助教、堤修一、和田洋一郎両特任准教授、油谷浩幸、児玉龍彦両教授、らの研究グループは、東京大学付属病院の興梠貴英特任助教、オックスフォード大学のCook博士、シンガポールゲノム研究所のRuan博士らのチームと共同で、NFkBを含み、miRNAホスト遺伝子群を同時に取り込む転写ファクトリーが存在することをことを明らかにした。本内容は2012年10月31日付でthe EMBO Journal電子版に"TNFa signals through specialized factories where responsive coding and miRNA genes are transcribed"と題して掲載された。
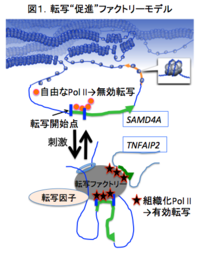
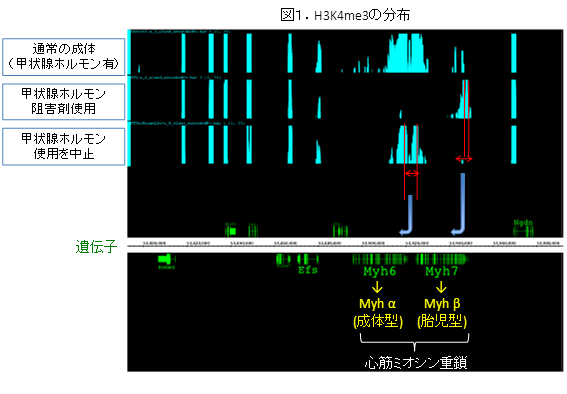
従来研究チームが報告してきたマイクロアレイの結果は、TNFα刺激によって誘導される遺伝子群のみならず、抑制される遺伝子群も明らかにしていたが、それらの遺伝子制御機構については充分明らかにされていなかった。そこで、既報の転写"促進"ファクトリー(図1)と同様の転写複合体によって、miRNAホスト遺伝子とTNFα抑制遺伝子が同時に転写されることによって、産生されたmiRNAが効率的にターゲット遺伝子産物にアプローチすることができる転写"抑制"ファクトリーが存在するという仮説をたてた。

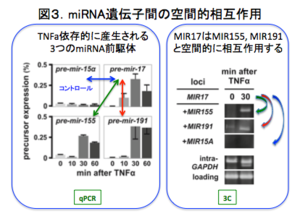
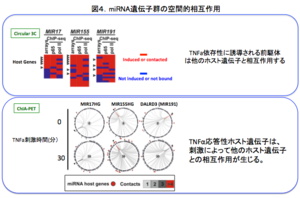
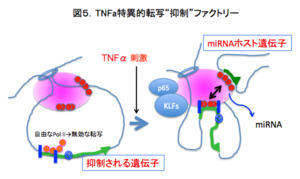
実際、TNFαによって誘導されるMIR155と他のmiRNAホスト遺伝子の間にはRNA-FISHによって空間的近接関係が認められる(図2)。さらに、Chromatin conformation capture (3C)によって、TNFα応答性のMIR17, MIR 155, MIR 191の間には空間的相互作用があることが確認された(図3)。さらに、Circular 3C, Chromatin internaction analysis with paired end tag sequencing (ChIA-PET)によって、全ゲノム的にmiRNAホスト遺伝子間の相互作用が炎症性刺激を仲介する転写因子であるNFKb1(p65), 及びPol IIに依存性して生じる事がわかった(図4)。これは、転写"制御"ファクトリーの存在を示す知見であり、図5に示す様な新しいmiRNAの作動概念を示唆する結果となった。
なお、本研究は、オックスフォード大学、シンガポールゲノム研究所、及び大阪大学木村宏 博士との協力によって実施された。
PMID:23103767
Journal Website: EMBO
DOI:10.1038/emboj.2012.288