2012年8月 8日
生体組織における発生過程のエピゲノム情報変化を直接解析する手法の開発
このほど、東京大学先端科学研究センター(東京都目黒区駒場、中野義昭所長)システム生物医学分野の三村維真理(現東大病院腎臓内科)、小林美佳、両研究員、児玉龍彦教授、和田洋一郎特任准教授の研究グループと東京大学付属病院の興梠貴英特任助教は、マウスの生体組織から直接クロマチン免液沈降を行う方法を開発し、組織におけるエピゲノム情報を解析することに成功した。マウスの心臓の発生過程において発現が胎児型から成体型に変化するミオシン重鎖の遺伝子発現変化を蛍光色の違いで識別できるマウスを開発していたノースカロライナ大学のKumar Pandya助教、Oliver Smithies教授と共同で、遺伝子発現変化にともなって実際にヒストン修飾が変化していることを証明した。
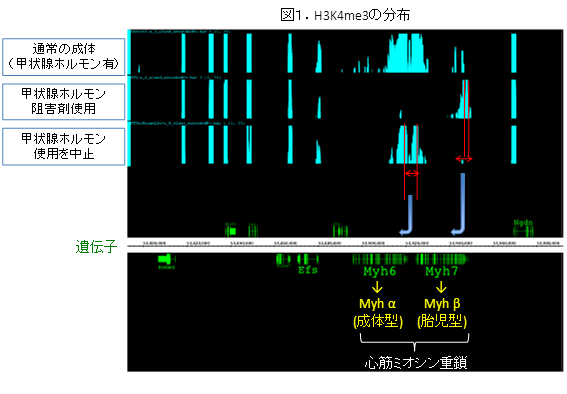
心臓におけるミオシン重鎖遺伝子は胎児型(α型)と成体型(β型)で異なっており、ゲノム上で隣接している別々の遺伝子(胎児型はMyh6、成体型はMyh7)から作られる(図1参照)。胎児型から成体型への発現のシフトは甲状腺ホルモンによって引き起こされる。実際、遺伝子の転写活性を反映するヒストン修飾の分布は、発生過程で胎児型遺伝子から成体型遺伝子へ移動する(図1上段)。しかし、甲状腺ホルモン阻害剤を使うと、活性型のヒストン修飾は胎児型ミオシン重鎖遺伝子上から動かなかった(図1中段)。しかしその後薬剤を中止したところ、活性型のヒストン修飾はきちんと成体型ミオシン重鎖遺伝子に移動することが確認され(図1下段)、このヒストン修飾分布の変化が発生過程において可逆的に制御されていることが明らかになった。
さらに、二つの遺伝子座の間にも活性型のヒストン修飾が見つかり、ここに未知のマイクロRNAの産生部位が存在すること、そしてこれが遺伝子発現調節メカニズムを解明する鍵となることを明らかにした。本内容は2012年6月付けでGene Expression誌に掲載された。
なお、本研究におけるヒストン修飾解析は大阪大学木村宏博士の協力によって実施された。
Distribution of histone3 lysine 4 trimethylation at T3-responsive loci in the heart during reversible changes in gene expression.
Pandya K, Kohro T, Mimura I, Kobayashi M, Wada Y, Kodama T, Smithies O.
Gene Expr. 2012;15(4):183-98.
PMID: 22783727
Journal Website: Gene Expression
DOI: 10.3727/105221612X13372578119698
